DFG fördert Lugdunin-Forschung: Interdisziplinäre Zusammenarbeit erforscht antimikrobielle Selektivität
November 2024. (English version below)
Die Deutsche Forschungsgemeinschaft (DFG) fördert das Forschungsprojekt „Entschlüsselung des membranselektiven Mechanismus von Lugdunin: Einblicke in die Spezifität für Gram-positive Bakterien und antimikrobielle Aktivität“. Die Studie ist eine interdisziplinäre Zusammenarbeit zwischen der Computational Biology an der Friedrich-Alexander-Universität Erlangen-Nürnberg unter der Leitung von Prof. Dr. Rainer Böckmann und der Arbeitsgruppe von Prof. Dr. Claudia Steinem an der Universität Göttingen.
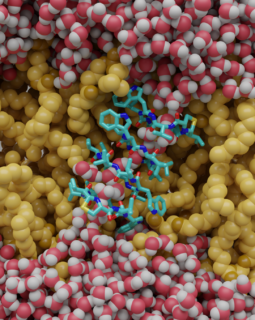
Das Projekt widmet sich der Untersuchung des membranselektiven Wirkmechanismus von Lugdunin, einem zyklischen Heptapeptid, das von Staphylococcus lugdunensis produziert wird. Lugdunin zeigt eine bemerkenswerte Wirkung gegen multiresistente gram-positive Bakterien, während es gegenüber gram-negativen Bakterien und menschlichen Zellen keine toxische Wirkung entfaltet. Frühere Untersuchungen deuten darauf hin, dass Lugdunin das Membranpotenzial von Pathogenen wie Staphylococcus aureus beeinflusst, indem es die Membran durchlässig für Protonen macht – ein Mechanismus, der bislang unvollständig verstanden ist.
Interdisziplinärer Ansatz zur Erforschung molekularer Mechanismen
Die Spezifität von Lugdunin für gram-positive Bakterien wird im Projekt auf deren charakteristische Membranlipidzusammensetzung zurückgeführt. Um diesen Mechanismus zu entschlüsseln, kombiniert die Studie modernste experimentelle Ansätze und Simulationsmethoden. Die Göttinger Arbeitsgruppe von Prof. Steinem bringt ihre Expertise in der in vitro Analyse von Modellmembranen ein, während die Arbeitsgruppe von Prof. Böckmann molekulardynamische Simulationen durchführt. Gemeinsam werden die Wechselwirkungen von Lugdunin mit Membranen untersucht, die die Eigenschaften gram-positiver und gram-negativer Bakterien sowie eukaryotischer Zellen nachbilden.
Das Projekt zielt darauf ab, die molekularen Interaktionen und strukturellen Faktoren zu identifizieren, die die antimikrobielle Aktivität und Membranselektivität von Lugdunin bestimmen. Diese Erkenntnisse könnten die Entwicklung neuer antimikrobieller Peptide vorantreiben und wegweisende Ansätze für die Behandlung von Infektionen durch multiresistente Bakterien liefern.
Die Zusammenarbeit zwischen der FAU Erlangen-Nürnberg und der Universität Göttingen ist ein wichtiger Schritt, um grundlegende Fragen der antimikrobiellen Forschung zu klären und gleichzeitig neue therapeutische Perspektiven im Kampf gegen resistente Infektionen aufzuzeigen.
DFG Funds Research on Lugdunin: Collaboration Between FAU Erlangen-Nürnberg and University of Göttingen Explores Selectivity of an Antimicrobial Peptide
The German Research Foundation (DFG) has approved funding for the research project: „Unraveling the Membrane-Selective Mechanism of Lugdunin: Insights into Specificity for Gram-Positive Bacteria and Antimicrobial Activity.“ This study is an interdisciplinary collaboration between the Computational Biology group at Friedrich-Alexander-Universität Erlangen-Nürnberg, led by Prof. Dr. Rainer Böckmann, and the group of Prof. Dr. Claudia Steinem at the University of Göttingen.
Focus on the Membrane-Selective Mechanism of Lugdunin
The project aims to investigate the membrane-selective mechanism of Lugdunin, a cyclic heptapeptide produced by Staphylococcus lugdunensis. Lugdunin exhibits remarkable activity against multi-resistant gram-positive bacteria while showing no toxic effects on gram-negative bacteria or human cells. Previous studies suggest that Lugdunin disrupts the membrane potential of pathogens such as Staphylococcus aureus by making the membrane permeable to protons—a mechanism that remains only partially understood.
Interdisciplinary Approach to Molecular Mechanism Research
The specificity of Lugdunin for gram-positive bacteria is hypothesized to result from their unique membrane lipid composition, which facilitates the peptide’s integration and antimicrobial activity. To unravel this mechanism, the study combines cutting-edge experimental and computational methods. Prof. Steinem’s group in Göttingen brings expertise in in vitro analysis of model membranes, while Prof. Böckmann’s team in Erlangen employs molecular dynamics simulations. Together, the teams investigate the interactions of Lugdunin with membranes that mimic the characteristics of gram-positive, gram-negative, and eukaryotic cells.
The project aims to identify the molecular interactions and structural determinants underlying the antimicrobial activity and membrane selectivity of Lugdunin. These findings could pave the way for the development of novel antimicrobial peptides and innovative approaches to combat infections caused by multi-resistant bacteria.
Collaborative Research Strengthens Antimicrobial Science
The collaboration between FAU Erlangen-Nürnberg and the University of Göttingen represents a significant step toward addressing fundamental questions in antimicrobial research. The DFG’s funding highlights the importance of this project in the global fight against multi-resistant bacterial infections while offering new therapeutic perspectives.